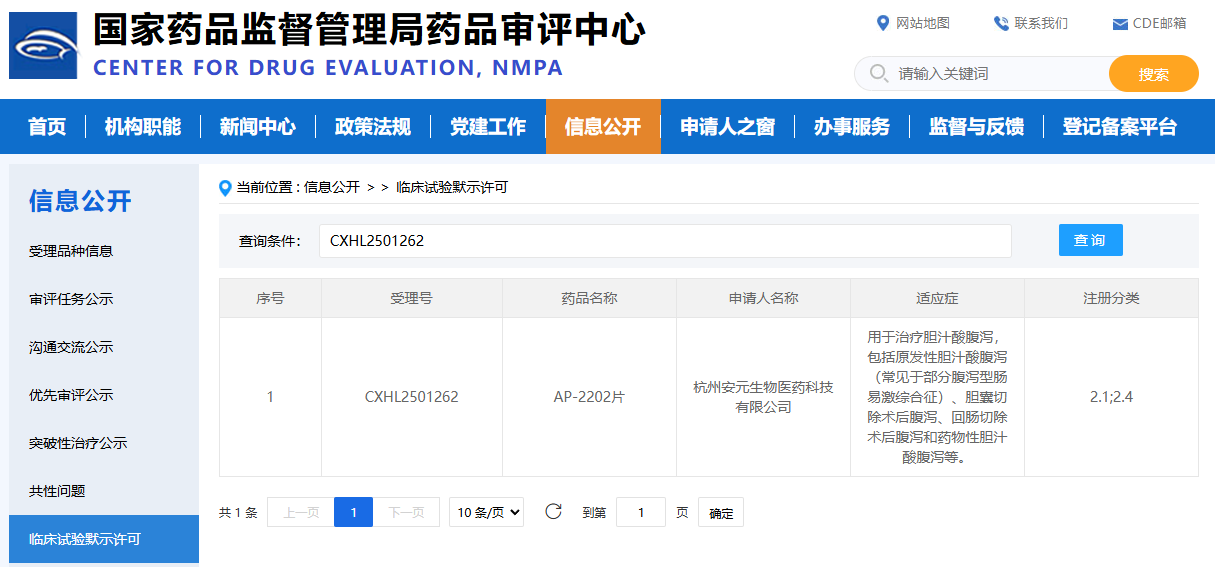
近日,杭州安元生物自主研发的二类新药AP-2202片收到国家药品监督管理局核准签发的《药物临床试验批准通知书》, 批准该药物在胆汁酸腹泻适应症中开展临床试验。
我国慢性腹泻的患病率为3%-5%,其中胆汁酸腹泻(BAD)是一项重要的、且常被忽视的病因。 据估计,高达50%的慢性腹泻病例可能由BAD引起。在临床常见的功能性肠病中,约25%-30%的腹泻型肠易激综合征患者实际存在BAD。尤其值得注意的是,在有明确胃肠手术史的患者群体中,BAD的发生率极高:例如,约89%的回肠切除术后患者、92%的克罗恩病肠切除术后患者,以及66%的胆囊切除术后患者均合并有BAD。然而,我国目前尚无任何药物正式获批“治疗胆汁酸腹泻”这一适应症,导致大量患者面临诊断不清、治疗无门的困境,存在巨大的未被满足的临床需求。
AP-2202片是一款全球首发的用于治疗胆汁酸腹泻及相关病症的创新药,临床前研究结果显示,该药物在有效性和安全性方面表现优异,具备显著的开发潜力。
此次临床试验申请的获批,是该项目研发历程中的重要里程碑,标志着AP-2202片正式进入临床研究阶段。杭州安元生物将按照国家药品注册相关法律法规要求,尽快启动临床试验,以系统评估药物在人体中的安全性和有效性,全力推进项目研发进程。